| |

Se determinó experimentalmente: la constante calorimétrica de
un calorímetro por medio del proceso de dilución de ácido sulfúrico en agua.
El valor obtenido de la constante K=0.06579875
Kcal./°C, valor para el se requirió de la
gráfica de Pickering
él que significa, que es la cantidad de calor necesario para elevar la
temperatura de toda la masa del calorímetro en un grado centígrado.
|
|
La
Calorimetría,
es la
ciencia que mide la cantidad de energía generada en procesos de intercambio
de calor.
El
Calor,
en física,
es la
transferencia de energía de una parte a otra de un cuerpo, o entre
diferentes cuerpos, en virtud de una diferencia de temperatura. El calor es
energía en tránsito; siempre fluye de una zona de mayor temperatura a una
zona de menor temperatura, con lo que eleva la temperatura de la segunda y
reduce la de la primera, siempre que el volumen de los cuerpos se mantenga
constante. La energía no fluye desde un objeto de temperatura baja a un
objeto de temperatura alta si no se realiza trabajo.
En las ciencias físicas, la cantidad de calor se expresa en las mismas
unidades que la energía y el trabajo, es decir, en julios. Otra unidad es la
caloría, definida como la cantidad de calor necesaria para elevar la
temperatura de 1 gramo de agua a 1 atmósfera de presión desde 15 hasta 16
°C. Esta unidad se denomina a veces caloría pequeña o caloría gramo para
distinguirla de la caloría grande, o kilocaloría, que equivale a 1,000
calorías y se emplea en nutrición.
Los procesos físicos por los que se produce la transferencia de calor son la
conducción y la radiación. Un tercer proceso, que también implica el
movimiento de materia, se denomina convección. La conducción requiere
contacto físico entre los cuerpos —o las partes de un cuerpo— que
intercambian calor, pero en la radiación no hace falta que los cuerpos estén
en contacto ni que haya materia entre ellos. La convección se produce a
través del movimiento de un líquido o un gas en contacto con un cuerpo de
temperatura diferente.
La cantidad de calor necesaria para aumentar en un grado la temperatura de
una unidad de masa de una sustancia se conoce como calor específico. Si el
calentamiento se produce manteniendo constante el volumen de la sustancia o
su presión, se habla de calor específico a volumen constante o a presión
constante. En todas las sustancias, el primero siempre es menor o igual que
el segundo. El calor específico del agua a 15 °C es de 4.185,5 julios por
kilogramo y grado Celsius. En el caso del agua y de otras sustancias
prácticamente incompresibles, no es necesario distinguir entre los calores
específicos a volumen constante y presión constante ya que son
aproximadamente iguales. Generalmente, los dos calores específicos de una
sustancia dependen de la temperatura.
La sensación de calor o frío al tocar una sustancia depende de su
temperatura, de la capacidad de la sustancia para conducir el calor y de
otros factores. Cuando se aporta calor a una sustancia, no sólo se eleva su
temperatura, con lo que proporciona una mayor sensación de calor, sino que
se producen alteraciones en varias propiedades físicas que pueden medirse
con precisión. Al variar la temperatura, las sustancias se dilatan o se
contraen, su resistencia eléctrica cambia, y —en el caso de un gas— su
presión varía. La variación de alguna de estas propiedades suele servir como
base para una escala numérica precisa de temperaturas.
La
Entalpía,
es la
cantidad
de energía de un sistema termodinámico que éste puede intercambiar con su
entorno. Por ejemplo, en una reacción química a presión constante, el cambio
de entalpía del sistema es el calor absorbido o desprendido en la reacción.
En un cambio de fase, por ejemplo de líquido a gas, el cambio de entalpía
del sistema es el calor latente, en este caso el de vaporización. En un
simple cambio de temperatura, el cambio de entalpía por cada grado de
variación corresponde a la capacidad calorífica del sistema a presión
constante. El término de entalpía fue acuñado por el físico alemán Rudolf
J.E. Clausius en 1850. Matemáticamente, la entalpía H
=
U + pV, donde
"U"
es la energía interna,
"p"
es la presión y
"V"
es el volumen.
"H"
se mide en julios.
Para determinar directamente la variación de calor comprendido en una
reacción, se usa el calorímetro. Hay diferentes tipos de calorímetros por
ejemplo, el adiabático, el de hielo, el de agua, pero para la
experimentación ocupamos el primero.
El calorímetro adiabático
es denominado así porque el recipiente exterior
se mantiene a la misma temperatura que la muestra a ensayar para evitar la
transferencia o transmisión de calor entre la muestra y el entorno exterior.
El
sistema (reactivos contenidos en el calorímetro), es una porción
del universo físico que nosotros consideramos para su estudio.
La
frontera es el mecanismo que separa al sistema del resto del universo
(paredes del calorímetro).
Los
alrededores o vecindad es la parte del universo que interacciona con
el sistema y sus alrededores está caracterizada por los intercambios mutuos
de energía en sus diversas formas.
Con respecto a lo anterior, el problema consistió en la construcción,
pero en especial, en la calibración del calorímetro por medio de el método
de la dilución del ácido sulfúrico en agua. La hipótesis planteada fue
que al hacer la dilución del ácido sulfúrico con agua dentro de el
calorímetro podríamos obtener el valor de la constante del calorímetro al
realizar las diferencias de temperaturas entre la inicial y la final (cuando
la temperatura permaneciera constante).
|
En los grandes procesos industriales no es raro que sea
necesario transferir cantidades relativamente grandes de energía térmica
entre el sistema y el medio ambiente o entre distintas partes de un sistema
dado. En el caso de los cambiadores de calor, equipos cuyo propósito
principales transferir el calor entre dos fluidos, estos no pueden
caracterizarse a través de un solo diseño; ya que las variedades de tal
equipo son prácticamente ilimitadas, aquí uno de los problemas principales
es el cálculo de los coeficientes para la transferencia de calor, en los
calorímetros, dispositivos, que nos permiten medir el calor de un sistema
reaccionante, el problema fundamental de la caracterización, es la
determinación de la constante de el calorímetro, obviamente no son el mismo
problema, pero en ambos dispositivos es necesario conocer la cantidad de
calor presente en el proceso y en ambos podemos encontrar los tres
mecanismos clásicos de la transferencia de calor, y en cada uno de los
equipos el uso, tratamiento y control es diferente. Por lo anterior la
construcción y calibración del calorímetro es una buena introducción para el
estudio y manejo de los mecanismos de la transferencia de calor como una de
las formas de energía y de importancia fundamental para la industria
química.
|
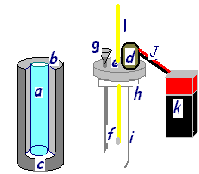
EQUIPO:
Para construir el calorímetro fueron necesarios los siguientes materiales:
-
Frasco de
vidrio (celda de reacciones)*.
-
Yeso (aislante)**.
-
Cubierta plástica.
-
Motor eléctrico.
-
Tapa de plástico
-
Embudo
-
Tapón.
-
Tapa de poli estireno.
-
Agitador.
-
Cables eléctricos
-
Batería eléctrica
(9 volts).
-
Termómetro
decimal.
* Frasco de vidrio:
sirvió como celda de reacciones, teniendo una conductividad térmica de 0.3
Btu/h pie2 (°F/pie).
**
Material que
sirvió como aislante pues tiene una capacidad
térmica de 0.25 Btu/h pie2 (°F/pie).
|
|
 |
|
MATERIAL: |
|
REACTIVOS: |
| |
|
|
|
|
|
-
Agua destilada:
usada para la preparación de todas las disoluciones.
-
Cloruro de bario:
utilizado para quitar carbonatos al agua para la preparación del
hidróxido de sodio 0.1 N
-
Hidróxido de sodio:
fue ocupado para la preparación de la solución patrón
secundario.
-
Ftalato ácido de potasio:
usado como estándar primario.
-
Ácido sulfúrico:
usado para la preparación de las diluciones para conocer la
constante del calorímetro.
-
Soluciones Buffer pH 4 y
7:
fueron
utilizadas para la calibración del
potenciómetro a los pH´s requeridos.
|
METODOLOGÍA:
Después de la
construcción del calorímetro, se procedió a la calibración. En primera
instancia se debió preparar la solución estándar primario, para ello se
desecó el ftalato ácido de potasio para quitarle el exceso de humedad, y se
pesó en cuatro ocasiones cerca de 0.7 g del mismo; cada una de estas
muestras se disolvió en agua. Estas soluciones sirvieron para la
preparación, por medio del método de titulación, del patrón secundario,
(hidróxido de sodio 0.1 N), que se preparó previamente, quitándole los
carbonatos con el cloruro de bario, durante la titulación se tomaron
lecturas de variación de pH con el potenciómetro y variaciones de volumen
que sirvieron para la determinación de la normalidad de la sosa. Ya
preparada la solución de sosa y conocida su concentración, se procedió a las
diluciones de ácido sulfúrico (3), en las cuales se midió la temperatura del
agua que se vertió en el calorímetro (100 mL) sin ácido durante varios
periodos de 30 segundos hasta lograr un equilibrio. Posteriormente se agregó
el ácido (0.25 mL) y se tomaron las variaciones de temperatura con los
mismos periodos de 30 segundos hasta volver a lograr un equilibrio,
posteriormente se graficó y se sacó la diferencia de temperaturas de cada
una de las corridas para obtener el
DT
de cada una y sacar el promedio que sirvió para la obtención de la
constante.
Posteriormente cada una de las diluciones de ácido se separó
en 4 partes de 20 mL y se titularon con la solución de sosa, ya con su
concentración conocida, de manera análoga como se hizo con el hidróxido de
sodio. La normalidad obtenida del ácido sirvió para la obtención de la
constante del calorímetro, al igual que el
DT se
le sacó promedio. Esta normalidad nos dio, de acuerdo a la gráfica de
Pickering, el valor de la constante del calorímetro (K).
Constante
Calorímetro
resultados
experimentales
Incremento
de la
temperatura
por
la
disolución
del
ácido
sulfúrico
en
agua
Titulación
del
ácido
Podemos darnos cuenta que logramos conseguir la constante de
nuestro calorímetro por medio del calor de dilución del ácido sulfúrico,
apoyándonos en la gráfica de Pickering la cual nos da el valor del calor
liberado sólo con conocer el
DT
y al concentración de nuestro ácido lo cual es una ayuda muy grande, porque
de hacerlo por otros métodos sería casi imposible ya que hay variables que
no se pueden medir con los materiales existentes en el laboratorio.
Por otro lado
no estamos satisfechos ya que aunque no esperábamos algún valor de la
constante, si estamos seguros de que no es la constante verdadera, debido a
que estamos concientes de que la forma en que se llevó a cabo la
experimentación no estuvo exenta de errores humanos, principalmente, como
pudieron ser malas mediciones de temperatura, de volumen, de tiempo, de pH,
etc.. Otro factor importante es que el calorímetro, al menos en este caso
tuvo fugas considerables de calor, porque aunque se trato de que estuviera
bien sellado, no se logró porque por el orificio por donde se le agregó el
ácido sulfúrico no se podía tapar tan rápidamente como se hubiera querido.
Todos estos son factores que definitivamente alteran los resultados finales,
pero que se pueden tratar de evitar en posteriores experimentaciones.
A pesar de
que se intentó tener los menores errores posibles, la experimentación no
estuvo exenta de ellos. Como se mencionó líneas arriba las fallas pudieron
ser de diversa índole, pero a nuestro parecer las que pudieron influir más
es la de la medición volumétrica (en especial del ácido sulfúrico) y la de
las fugas de calor.
Se propone
para evitar estos errores, llevar a cabo las siguientes recomendaciones:
Para evitar
el error de medición del volumen del ácido se recomienda usar perilla de
seguridad, pues esta herramienta permite agregar cantidades más exactas del
líquido, al igual se recomienda el uso de una pipeta graduada de 1 ml
dividido el 100 unidades.
Para evitar
la fuga de calor se recomienda que el tapón del tubo por donde se vierten
los reactivos sea más grande que el que se utilizó en esta experimentación y
que sea de otro material, que en este caso sirve bien un gotero de plástico
que embona a la perfección.
Seguramente
que estas recomendaciones ayudarían a una mejor experimentación y un
resultado más preciso, que como consecuencia nos dejaría más satisfechos.
-
AYRES, G. H. Análisis químico cuantitativo. Harla.
México 1978.
-
BURMISTROVA, O. A. Prácticas de química física.
Editorial Mir, Moscú 1986.
-
KERN, Donald Q. Procesos de transferencia de calor.
8ª reimpresión. Compañía Editorial Continental. S.A. México, 1974.
-
JONES, JB (et, al.). Ingeniería Termodinámica.
Prentice Hall. México 1995.
-
MORAN, M.
J. (et, al.).
Fundamentos de termodinámica técnica.
Segundo tomo. Reverté, Barcelona 1995.
-
OROZCO, D. F. Análisis químico cuantitativo, Porrúa.
México, 1978
-
PALMER, W. G. Química física experimental, EUDEBA, Buenos Aires,
1966.
|
|