| |
|
|
| |
Propósito
los conocimientos estudiados en la unidad de aprendizaje correspondiente a
la parte de equilibrio químico para: consolidar los
aspectos teóricos, junto con los conocimientos adquiridos a través de la
determinación experimental de las constantes de equilibrio y la forma de
cuantificarlas, y
típicos de la misma.
|
|
| |
|
|
| |
 |
|
|
| |
|
|
| |
Preguntas:
| Defina con sus propias palabras: |
Representar por medio de la ecuación
matemática:
|
-
Equilibrio Químico
-
Ley de acción
de masas
-
Constante de
equilibrio KC y KP , y cuál es su
relación
-
Características
generales de la constante de equilibrio
-
El significado físico
del valor de la constante de equilibrio
-
El principio de
Le Chatelier
-
Los factores que
afectan el equilibrio
-
El Producto de
solubilidad
-
El efecto del
Ion común
-
El efecto salino
|
-
Ley de acción de masas
-
Constante de
equilibrio KC y KP es su relación
-
Producto de
solubilidad
|
Problemas:
1.-) A 25°C, una solución 0.0100 M de
ácido acético (HC2H3O2) está ionizada 4.18%¿Cuál es
la constante de ionización Ka para el ácido acético? Suponga que
tiene un litro de solución.
|
|
| |
|
|
| |
 |
|
"Tips":
En
este ejemplo, el ácido acético en presencia de agua, se ioniza de la
siguiente manera:
|
CH3COOH |
+ |
H2O |
D |
H3O+ |
+ |
CH3COO- |
Por supuesto, no olvide el
|
|
| |
|
|
| |
2.-)
¿Cuáles son las concentraciones de todas las
especies presentes en ácido acético 1.00M a 25°C?
Si para el HC2H3O2, la Ka
es 1.8 *10-5 . |
|
| |
|
|
| |
 |
|
"Tips":
En
este problema, se puede considerar que si X es
igual al número de moles de
HC2H3O2
en forma iónica en 1 litro de solución, las concentraciones en equilibrio
son:
|
CH3COOH |
D |
H+ |
+ |
CH3COO- |
|
(1.00 - x) M |
|
x M |
|
x M |
Si la constante de
equilibrio es:
|
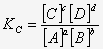 |
|
entonces
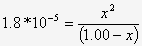 |
|
|
| |
|
|
| |
3.-) ¿Cuál es pH de una solución que
tiene una concentración de [ H+] de 0.050 M. ? y ¿Cuál es la [ H+]
de una solución que tiene un pH de 10.60 ? |
|
| |
|
|
| |
 |
|
"Tips":
En
este problema,
recuerde que:
pH = - log [ H+]
|
|
| |
|
|
| |
4.-) ¿Cuáles son las concentraciones de todas las
especies presentes en una solución hecha diluyendo 0.10 moles de HCl y 0.50
moles de NaC2H3O2
hasta un litro. |
|
| |
|
|
| |
 |
|
"Tips":
Se
puede preparar un sistema en equilibrio de un electrolito débil de los
compuestos que suministran los iones de electrolito débil. Por tanto
considere al ácido clorhídrico y al acetato de sodio como electrólitos
fuertes. Por lo tanto, podemos
suponer que antes de alcanzar el equilibrio la concentración de
[ H+] es 0.10 M y la
concentración de
CH3COO-
es 0.050 M.
Datos
|
|
| |
|
|
| |
5.-) ¿Cuáles son
las concentraciones de todas las especies presentes en una solución 0.10 M
de HNO2 a 25 °C?
|
|
| |
|
|
| |
 |
|
"Tips":
Para el
HNO2, Ka es 4.5 *10-4
|
|
| |
|
|
| |
6.-) Una solución es 0.10 M en Cl-
y 0.10 M en CrO42-.
Si se agrega lentamente AgNO3 sólido a esta solución, ¿cuál se
precipitará primero, AgCl o Ag2CrO4? Suponga que la
adición no causa cambio en volumen. Para AgCl, KPS=1.7x10-10
; para Ag2CrO4, KPS=1.9x10-12
.
|
|
| |
|
|
| |
 |
|
"Tips":
Cuando se comienza a formar un
precipitado, el producto iónico respectivo apenas excede la
KPS del sólido. Por consiguiente,
calculamos las concentraciones dde Ag+
necesarias para precipitar AgCl y Ag2CrO4.
|
AgCl(s)
D
Ag+ +
Cl-
|
Ag2CrO4
D
2 Ag+ +
CrO42-
|
|
? 0.10 M |
?
0.10 M |
|
|
| |
|
|
| |
7.-)
¿Qué concentración de SO42-(ac)
se necesita para comenzar la precipitación de BaSO4 a
partir de una solución saturada de BaF2 ?
|
|
| |
|
|
| |
 |
|
"Tips":
Consulte tablas de
KPS
.
|
|
| |
|
|
| |
|
|