
Estudo da Metodologia do Uso da Placa de Rosenthall - By Rui Freitas
( Contador de Células )
INDICE
I - INTRODUÇÃO
*OBJECTIVO DAS PRÁTICAS
*AULA PRATICA N.º 2 / ECOLOGIA
*1. MATERIAIS
*2. METODOLOGIA E DESCRIÇÃO
*Metodologia da contagem das células
*3. RESULTADOS
*4. DISCURSÃO
*Intervalos de Confiança
*Teste de Student(t)
*5. CONCLUSÃO
*AULA PRÁTICA N.º 3 / ECOLOGIA
*1. MATERIAIS
*2. METODOLOGIA E DESCRIÇÃO
*3. RESULTADOS
*4. DISCURSÃO
*5. CONCLUSÃO
*Placa de Rosenthall, não passa de uma lamina especializada, para o uso no microscópio óptico simples de luz natural ou artificial. Com vários riscos microscópicos em rede, serve sobretudo para contar células difundidas na água( como solvente universal ). É especialmente usada no ramo Aquacultura, onde ajuda a determinar por volume de água as variações no n.º de células de fitoplâncton. Usando métodos estatísticos, conhecendo a altura entre a placa e a lamela, as dimensões das microriscos extrapola-se o n.º de células previamente fixadas por mm3 de água.
Assim esse numero pode variar por espécie de fitoplâncton ou no tempo( pelo consumo dos mesmos). Nas práticas trabalhamos com seguintes espécies de fitoplâncton :
OBJECTIVO DAS PRÁTICAS
No trabalho vou referir a "amostras" no caso de um quadrado menor(de 25x10-4 mm2 ), e de sub-amostras no caso de vários quadrados ou seja 1 grande que contem 16 pequenos(16 x 25x10-4 mm2 = 4x10-2 mm2).
DIA: 10-12-99
HORA: 15:30
LOCAL: LABORATÓRIO DE AQUACULTURA DO INDP( Cova d'Inglesa-Mindelo )
Consoante a metodologia geral da pratica, assim realmente ocorreu, dentro das normas e os passos predefinidos.
O primeiro passo segundo a metodologia seria fixar as células com solução de Lugol.
Estes estavam em pequenos beckers, dissolvidos vivos no meio de cultivo. Deitamos em ambas as espécies uma a duas gotas de Lugol, com o intuito de as fixar, matando-as e imobilizando-as assim, visto que são células fotossintectizadores com flagelados. Deixamos em repouso enquanto passava-se para o segundo passo.
O segundo passo seria limpar todo o material óptico, e as lentes do microscópio. Com álcool limpar a placa de Rosenthall e as lamelas, secando-as posteriormente com um lenço de papel limpo.
O terceiro passo seria colocar a lamela sobre a placa segundo a posição geometricamente ideal.
O quarto e o quinto passo era com a ajuda de uma seringa que no nosso caso seria com um canta gotas colocar uma gota de cultivo fixado, e previamente homogeneizado entre a placa e a lamela, onde o liquido aquoso usando propriedades de pressão osmótica e de capilaridade da água, vai assim espalhar para toda a área disponível. Dá-se um pequeno golpe em cima da lamela, com o dedo para ajudar a distribuição equidistante do liquido.
O sexto e o sétimo passo seria deixar em repouso durante 5-10 min. e de seguida com o auxilio do microscópio efectuar a contagem das células segundo a ampliação e luz apropriado da maquina( x400, e luz não muito forte para poder ver os riscos).
Metodologia da contagem das células
Na contagem do numero de células distribuídas, tomamos o menor quadrado visto na placa, o que contem 25x10-4 mm2 de área. Contamos o n.º de células por cada quadrado desses, e formam na placa um quadrado maior contendo 4x10-2 mm2, preenchendo assim toda a visão esférica da objectiva, ou seja o quadrado maior tem 16 quadrados pequenos. Isso na ampliação geral da imagem vista tem x400. Ou seja 16 quadrados pequenos são 1 grande de 4x10-2 mm2. (16 x 25x10-4 mm2 = 4x10-2 mm2). Sucessivamente vai-se saindo dum nível microscópico, tendendo para quadrados vistos pela vista desarmada. Isso porque a placa tem outros quadrados mais grandes ou seja, 25 quadrados de 4x10-2 mm2 forma um mais grande de 1 mm2.
Este por sua vez é constituído por 9 quadrados maiores( 9 mm2 ) visto á vista desarmada.
Mas contudo o nosso ponto de referencia a nível de cálculos situa a 1 mm2, visto ser muito demoroso contar todas as células existentes em 9 mm2 , até mesmo em 1 mm2. Assim usando a estatística e a regra dos três simples, faz-se a contagem de células nos 16 quadrados de 25x10-4 mm2, faz-se a média desses, e de seguida extrapola-se o n.º de células para 4x10-2 mm2 multiplicando por 16, de seguida x 25 para saber o n.º de células em 1 mm2 de cultivo. Mas como nos interessa saber o n.º por área(mm3) , é nos dado a altura média do liquido existente entre a placa e a lamela, que é de 0.1 mm. Assim sabendo o numero de células por 1mm2, multiplica-se mais uma vez por 0.1 mm e finalmente obtém-se o numero de células por mm3 de cultivo. Esse numero da concentração geralmente varia consoante a espécie, a e realidade a testar.

Assim o quadrado negro tem 25x10-4 mm2 e o todo cinzento tem 4x10-2 mm2 a imagem observada na objectiva terá relativamente este tamanho e forma esférico em relação á escala. Assim o numero de células de fitoplâncton( Platymonas sp. ) encontradas por mi são :
|
7 |
9 |
6 |
7 |
|
6 |
13 |
9 |
14 |
|
9 |
8 |
16 |
6 |
|
9 |
6 |
5 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Neste caso o quadrado maior tem 1 mm2 e o cinzento é o grande em cima que tem 4x10-2 mm2.
Ainda temos um mais grande visto á vista desarmada que tem 9 mm2 de área, onde cada um dos quadrados representa o grande acima. com 3 mm de cada lado e ainda tem excessos de linhas que se prolongam para fora da área de interesse da placa.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MEDIA ARITMÉTRI. |
8,5 |
|
COFE. DE VARIA (%) |
38 |
|
MEDIA PONDERA. |
8,5 |
|
VARIANCIA |
10,4 |
|
DESVIO PADRÃO |
3,22 |
|
ERRO PADRÃO |
0,81 |
|
NUM. DE SUB-AMOSTRA |
16 |
Assim consoante a minha media de 8.5 células/ 25x10-4 mm2, e extrapolando, ou seja
8.5x16x25 para área e de seguida dividir por 0.1 referente ao volume( 0.1mm = altura do liquido entre a lamina e a lamela), a onde por si só multiplica com o 25x10-4 mm2 no denominador, obtenho, assim 34.000 células / mm3. E como 1 Litro = 1 dm3, assim temos 34.000 células / ml de cultivo de Platymonas sp. Para maior fidelidade e significancia desse numero por volume de cultivo, e para fazer elo de comparação, pedi os dados de 2 outros colegas, formado num total 48 sub-amostras de 25x10-4 mm2 . Assim obtive :
|
MEDIA ARITMÉTRI. |
7,2 |
|
COFE. DE VARIA (%) |
38 |
|
MEDIA PONDERA. |
7,2 |
|
VARIANCIA |
7,3 |
|
DESVIO PADRÃO |
2,7 |
|
ERRO PADRÃO |
0,39 |
|
NUM. DE SUB-AMOSTRA |
48 |
Neste caso, feito os cálculos, e dá 28.800 células / ml de cultivo.
|
17 |
28 |
12 |
- |
|
- |
- |
- |
- |
|
- |
- |
- |
- |
|
- |
- |
- |
- |
Aqui os dados estatísticos são :
|
MEDIA ARITMÉTRI. |
19,0 |
|
COFE. DE VARIA (%) |
43 |
|
MEDIA PONDERA. |
19 |
|
VARIANCIA |
67 |
|
DESVIO PADRÃO |
8,19 |
|
ERRO PADRÃO |
4,73 |
|
NUM. DE SUB-AMOSTRA |
3 |
Aqui extrapolando segundo o método, teríamos 76.000 células / ml do cultivo de Dicroteria sp.
Com 95 % de confiança determinei os intervalos correspondentes onde a tal media por 25x10-4 mm2 tem a probabilidade de 95 % de conter a verdadeira média ou seja, é o intervalo onde encontra a media real se por exemplo realizar-mos 95 experiências dessas nas mesmas condições de experiência. Para 95% o σ = 5% na tabela T( student ). Para os casos de sub-amostras >30 , uso a variável normal Z= ± 1,96 e para casos de distribuição t com o uso da tabela com n-1 graus de liberdade(GL) , e para o σ predefinido e onde n = n.º sub-amostras .
Para Platymonas sp. ( n=16), o intervalo de confiança da media 34.000 células / ml é de 34.000±1.7
MEU CASO P(33.998<media<34.002)=95%.
Para Platymonas sp. ( n=48), o intervalo de confiança da media 28.800 células / ml é de 28.800±0.76
P(28.799<media<28.801)=95%.
Para Dicroteria sp. ( n=3), o intervalo de confiança da media 76.000 células / ml é de 76.000±20
P(75.980<media<76.020)=95%.
Para Platymonas sp. ( n=16), o intervalo de confiança da media é 34.000 células / ml é de 34.000±1.7 . P(33.998<media<34.002)=95%. Admita-mos que eu quero agora uma média±1, ou seja E=1, e sozinho sem dados( sub-amostras de outros). Estatisticamente e matematicamente neste caso, e nas mesmas condições de experiência teria que contar sozinho um n.º total de 47 sub-amostras de 25x10-4 mm2 ou seja nos quadrados mais pequenos.
Tendo obtido duas medias para sub-amostras diferentes há que se fazer um teste para ver que correspondem á mesma realidade.
Assumo que a sub-amostra n=48 como a população e a minha como uma sub-sub-amostra dessa população. Assim temos que considerar que se a minha media estiver na área coberta por 95% da distribuição de ± 28.800, a minha é igual, mas se estiver 5% fora dessa área ela é diferente. Assim assumo o σ=5%: H0=media(n=16)=media(n=48) H0=34.000=28.800
Sabendo que na tab. t para GL=15 temos t=2,13 , calculando ;
t=( minha média - media(48) ) / erro da minha sub-amostra = 1,67
Assim | t | = 1,67 < t5%(15)=2,13 , conclui-se que a probabilidade de que as duas medias pertençam á mesma distribuição de frequências é maior do que 5%, assim dentro dos seguintes pressupostos de H0 conclui-se que as duas sub-amostras são eficientes.
Ainda fiz o teste de significância (t) da diferença entre duas médias H0=34.000=28.800
Consoante os resultados para 95% e GL=62 temos | t | = 1,587 < t5%(62)= 1,98 assim mais uma prova que as duas sub-amostras são da mesma realidade ou seja entre uma placa e uma lamela.
Assim posso concluir que esta prática conclui-o com êxito , consoante as condições predefinidos. Usando uma tabela de "student" e uma calculadora cientifica, pode-se modelar os resultados pretendidos, em termos de erros e intervalos de confiança pretendidos. Os coeficientes de variação dos dados não chegam a 50% o que podemos dizer que podem ser significativas. Realmente aprendeu-se a contar células de fitoplâncton com a placa de Rosenthall, mas em relação ás células que ficam nos riscos usam-se a teoria do "futebol"( mais para um lado ou para o outro). Em relação Dicroteria sp. as 3 sub-amostras não chegam para definir concretamente a concentração por ml, mas mesmo assim tem maior concentração do que a Platymonas sp como fitoplâncton.
DIA: 17-12-99
HORA: 15:00
LOCAL: LABORATÓRIO DE AQUACULTURA DO INDP( Cova d'Inglesa-Mindelo )
Consoante a metodologia geral da pratica, assim realmente ocorreu, dentro das normas e os passos predefinidos, mas o factor tempo determinou na escassez de dados nesta aula prática.
Usando a mesma metodologia da prática anterior, ou seja de contagem de células de fitoplâncton, este, tem como objectivo principal calcular a taxa de filtração do fitoplâncton através dum único indivíduo de moluscos bivalve( Mytilus smaragdinus ) em função do tempo. Sendo um filtrador o animal filtrará o fitoplâncton em cultura com água, num becker, simulando uma situação natural. Quando os 200 ml de fitoplâncton condensado foi colocado dentro do becker, foi posteriormente diluída 3 vezes com água preenchendo no total 800 ml = 200cultico +600água. Com a placa de rosenthall será contada e determinada a concentração inicial do fitoplâncton( nº cel. /ml ). De seguida é introduzido o animal dentro do becker, onde dentro das condições criadas vai iniciar a filtrar o fitoplâncton. De 20 em 20 minutos é retirada uma amostra da água em constante filtragem pelo molusco, e segundo a técnica( com a placa de rosenthall ) será medida novamente a concentração do fitoplâncton, e determinar assim a taxa de filtração do molusco. Os resultados serão analisados segundo modelos pré definidos e o tempo será medido em unidades por hora.
A curva da taxa será definida segundo a função F( t ) = C0.e-k.t , onde C0 é a concentração inicial da experiência, o " e " será a constante de Nepen, o " t " é a variável e o " k " será o declive da tangente da recta, que é dada pela equação; K = ( lnc1 – lnc2 ) / ( t2 – t1 ) .
Aqui são os respectivos tempos(h) e as respectivas concentrações correspondentes.
A taxa de filtração propriamente dita será determinada pela equação :
V(ml) / n( nº de indivíduos) x K
Segundo a amostra inicial antes da introdução do molusco no becker a 800 ml de cultivo obtemos os seguintes valores com a contagem de células, isso para tempo inicial ;
|
7 |
8 |
5 |
5 |
|
4 |
7 |
5 |
10 |
|
10 |
9 |
8 |
7 |
|
7 |
8 |
6 |
7 |
Atendendo ás estatísticas temos ;
|
MEDIA ARITMÉTRI. |
7.06 |
|
COFE. DE VARIA (%) |
25 |
|
MEDIA PONDERA. |
7 |
|
VARIANCIA |
3 |
|
DESVIO PADRÃO |
1.77 |
|
ERRO PADRÃO |
0.44 |
|
NUM. DE SUB-AMOSTRA |
16 |
Extrapolando os dados teremos como C0 = 28.250
células / ml , o que representa a concentração inicial da experiência.Nos 20 minutos seguintes os resultados foram ;
|
0 |
2 |
1 |
2 |
|
0 |
0 |
0 |
1 |
|
0 |
1 |
2 |
1 |
|
0 |
1 |
0 |
1 |
Atendendo ás estatísticas temos ;
|
MEDIA ARITMÉTRI. |
0.75 |
|
COFE. DE VARIA (%) |
103 |
|
MEDIA PONDERA. |
1 |
|
VARIANCIA |
1 |
|
DESVIO PADRÃO |
0.77 |
|
ERRO PADRÃO |
0.19 |
|
NUM. DE SUB-AMOSTRA |
16 |
Extrapolando os dados teremos como C1 = 3.000
células / ml , o que representa a concentração após 20 minutos do inicio da experiência.Nos 40 minutos após o inicio e no fim da experiência os resultados foram ;
|
0 |
1 |
1 |
0 |
|
0 |
0 |
0 |
1 |
|
0 |
0 |
1 |
0 |
|
1 |
0 |
3 |
0 |
Atendendo ás estatísticas temos ;
|
MEDIA ARITMÉTRI. |
0.50 |
|
COFE. DE VARIA (%) |
163 |
|
MEDIA PONDERA. |
1 |
|
VARIANCIA |
1 |
|
DESVIO PADRÃO |
0.82 |
|
ERRO PADRÃO |
0.20 |
|
NUM. DE SUB-AMOSTRA |
16 |
Extrapolando os dados teremos como C2 = 2.000
células / ml , o que representa a concentração após 40 minutos do inicio da experiência, sendo este as ultimas amostras tiradas.Assim temos as seguintes concentrações do fitoplâncton devido a acção filtradora do molusco :
Assumindo os tempos de C1 de 20 min = 0.3 horas , e de C2 o valor de 40 min = 0.6 horas, e consoante a equação para k ;
K = ( lnc1 – lnc2 ) / ( t2 – t1 ) , teremos como declive ( k ) = 1.22
Tendo K formaremos a equação da curva da taxa de filtração em função do tempo, traduzida em
F( t ) = 28.250 x e-1.22 x t
A curva será : CURVA DE FILTRAÇÃO
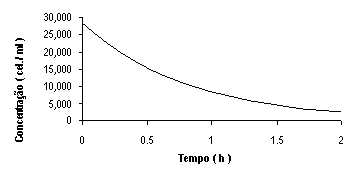
Calculando realmente a taxa de filtração e atendendo a equação V(ml) / n( nº de indivíduos) x K teremos um volume de 800 ml e um só indivíduo, com o k = 1.22 temos a taxa de
976 células/hora/indivíduo. Atendendo ás unidades K = Concentração/tempo , sendo igual a
células/(hora x ml) , na taxa como unidades temos ( ml / indivíduo ) x (células/(hora x ml)) .
O método é bom, mas aqui alem dos dados são poucos e não chega para definir contritamente a taxa, poderão estar esses dados viciados, visto que num espaço de 20 minutos, um valor de 28.250 células/ml, desceu drasticamente para 3.000 e de seguida aos 40 minutos a 2.000 . Isso leva a pensar que existe algum erro ou incoerência dos dados, mas caso contrario será objecto duma investigação profunda na biologia desta espécie, em função do modo de filtração, visto que do inicio a concentração desceu drasticamente segundo os dados recolhidos. Em função disso é feito uma constatação e avanço com uma hipótese.
Atendendo ás informações dado pela equação da curva de filtração permite discutir, que a pouca informação( duas só alem da inicial ) interferem grandemente na coerência dos dados a 0.4 e 0.6 horas, em relação com o observado ;
comparado com o calculado com os dados disponíveis(Tabela 1) . Segundo a equação da curva os dados estão longe de corresponder á mesma realidade quando comparados a 20 e 40 minutos, assim era preciso obter mais informações durante um maior intervalo de tempo ( talvez um dia ) . Posso admitir que a taxa calculada não corresponde á realidade observada mas sim tende para um valor puramente teórico.
Tabela 1
|
Tempo(h) |
C( c/lm) |
|
0.1 |
25,014 |
|
0.2 |
22,149 |
|
0.333 |
18,833 |
|
0.4 |
17,366 |
|
0.5 |
15,377 |
|
0.666 |
12,556 |
|
0.7 |
12,057 |
|
0.8 |
10,676 |
|
0.9 |
9,453 |
|
1 |
8,370 |
Uma outra razão da incoerência dos dados pode ser explicado devido ao stress do animal dentro dum becker de vidro , que não é o ambiente natural dum molusco.
Isso porque demorou muito tempo para abrir o bivalve( Mytilus smaragdinus )e iniciar a filtragem do fitoplâncton o que possivelmente não foi igual quando está no seu ambiente natural . Possivelmente no seu ecossistema natural e/ou no tanque de aquacultura a taxa de filtração seja totalmente outra.
Assim posso concluir que esta prática foi efectuada com um certo êxito , consoante as condições predefinidos e disponíveis. Mas o factor tempo que foi extremamente pouco determinou grandemente o nº de dados tirados o que influencia a coerência da taxa final que era o objectivo fulcral do trabalho. Realmente aprendeu-se com o contador de células a contar células com a placa de Rosenthall, e também a metodologia para calcular esse tipo de taxa muito importante para possíveis investigações de aquacultura. Outro aspecto importante é que a partir desses dados é possível prever matematicamente ou talvez só teoricamente uma situação real do consumo do fitoplâncton em função do tempo. Assim saberemos, a um erro mínimo quanto fitoplâncton é preciso para o consumo de um numero de indivíduos bivalves durante um tempo determinado. Isso segundo a tendência da real curva de filtração.
Assimilado o método proponho em tempo oportuno efectuar de novo esta pratica, mas sim duma forma mais coerente e rigoroso em relação aos dados disponíveis, e por um período de tempo mais longo. Para contar células é preciso muita precisão e paciência, só assim os dados poderão traduzir uma realidade....