
身の回りには欠かせない、「鉄」に関して考えましょう。
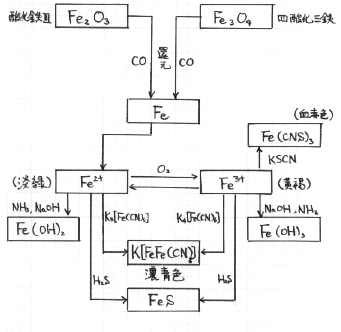
鉄イオンにはFe2+とFe3+の二種類があります。
鉄原子からイオン化する時は、基本的に直接Fe3+にはならず、最初になるのはFe2+です。
 Fe2++2e-
Fe2++2e-
 Fe3++e-
Fe3++e-Fe3+はFe2+を経由して生じます。
御承知の通り、鉄鉱石から作ります。鉄鉱石に含まれるのは酸化鉄なので、製鉄の主な役目は、還元する事です。
還元にはコークス(炭素)を燃やして作る一酸化炭素の還元力を利用します。
 2CO
2CO
 2Fe+3CO2
2Fe+3CO2
詳細に関しては、製鉄のページをご覧ください。
水溶液中に鉄が含まれるかどうかの検出方法は、Fe2+とFe3+で異なります。
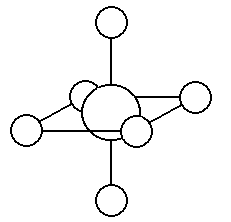
錯イオン配位数は6で、左の構造です。

写真左はFeCl3、写真右はFe(OH)3。
赤サビ:Fe2O3(三酸化二鉄):鉄を酸素と反応させると生じる。
黒サビ:Fe3O4(四酸化三鉄):高温で水蒸気と反応させると生じる。
Fe3O4はFeO・Fe2O3の混ざったもの。
黒色。塩基性酸化物で酸に溶ける。