水分子はご承知の通りH2Oです。
が、これも平衡なんですよ。水分子全部が全部、H2Oのままは存在して居ないのです。
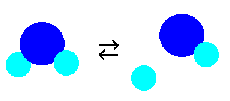
 H++OH-
H++OH-
水の分子の中には必ず電離(イオンになって分かれる事)している奴が居ます。数は少ないですが、決して零ではなく、少しだけ必ず、H+とOH-が存在します。
どの位存在するかと言いますと、ある法則が成り立ちます。
それを説明するために、一つの記号を覚えて下さい。
記号、[と]で囲んで「濃度」を表す事にします。つまり、[H+]と書けば「水素イオンの濃度」、[OH-]と書けば「水酸化物イオンの濃度」の意味になります。例えば、
[H+]=10-5mol/l
の様に使います。
で、常温常圧(00C、1気圧)程度では、[H+]と[OH-]を掛け合わせると、必ず10-14になるという事が分かっています。
ですから例えば、水の中に[H+]が10-5あったとしたら、必ず[OH-]は10-9ある事が分かるのですね。
ところでここで、中学校で「酸とはH+が溶けている物」と習ったと思いますが、これがちょっとおかしい事が分かると思います。[H+]と[OH-]を掛けると10-14ですから、[H+]も[OH-]も、零になることは有り得ないのです。(どっちかが零なら、掛けたら零になるから)
だから正しくは「酸性とはH+の方がOH-の数より多い事」「塩基性(アルカリ性)とはOH-がH+より多い事」を言います。だから「中性はH+とOH-の数が等しい事」なんですね。
掛けて10-14なのだから、H+とOH-の数が等しいなら、[H+]=10-7なんですね。言い換えると「中性とは[H+]=10-7である事」なんです。
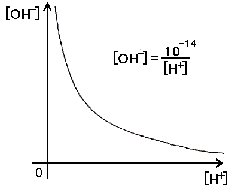
ついでに当たり前の話なんですけど、ちょっと説明しておきますが、[H+]・[OH-]=10-14なんでしょ? この式を変形してみる([H+]で両辺を割る)と、反比例になりますね。
ですから[H+]も[OH-]も零にならないはずですね?
常にグラフを考える習慣をつけて下さいね。
補足:
基本的には、[H+]・[OH-]=10-14 は、常に成立するものと考えて頂いて結構です。酸性でも塩基性でも成り立ちます。
しかし正確に言いますと、10-14という数字は、温度によって変化します。
10-14 が成り立つのは25℃の場合の話で、温度が変化すると、若干変化します。
最初の内は、気にしなくて良いですが、正確には 10-14 とは限りません。
iwamoto先生、ご指摘ありがとうございました。