

水は水分子の集まりであるのは、中学校で学んだ通りです。
で、水分子というのは、水素原子二個と酸素原子一個がつながってできているのですね。その形は図の通りで、三つの原子は決してまっすぐ並んでいるのではなくて、曲がってくっついています。ここが結構大事でして、このために水は独特な性質を持ちます。
水分子はイオンではありませんので、電荷はありません。 と、それは事実なのですが、ここで強調したいのは、「水分子全体 としては電荷がプラスマイナス 零」なのであって、「部分的にも電荷を持たないという訳ではない」という事です。 どういう事でしょうか? 水分子は、水素原子が一つ、酸素原子が一つずつの不対電子を提供して、共有結合して繋がっているのですよね?ということは、共有 電子対は酸素と水素の間にあるんですね?それはその通りです。
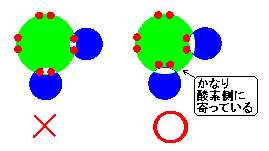
しかし、共有電子対は、酸素と水素の丁度真ん中にある訳ではないのです。実際には真ん中より酸素に寄った位置にあります。何故かと言いますと、「酸素の方が水素よりも電子を引きつける力が強い」からです。 元素によって 電子を引きつける力は違います。この「電子を引きつける力」の事を「電気陰性度」と言います。酸素の電気陰性度は水素 の電気陰性度よりもかなり大きいんです。ですから共有電子対は、酸素寄りに位置する訳です。

ですから酸素は水素と共有結合する事で、若干マイナスぎみになります。(でもイオンのO-ほどではありません。イオンになる訳ではないんです)
一方で水素は、一応、共有電子対を共有しているには違いはないのですが、電子を取られたに近いものがあります。ですからややプラスになる訳なんです。(でもH+になる訳ではないんですよ。完全に電子を奪われている訳ではないですからね。)
つまり、水分子は全体としてはプラスマイナス零であるには違いないのですが、電子は偏って存在しています。
ところで中学校で習った通り、電気はプラスとマイナスが引きつけ合うのでしたね。ですから隣り合う水分子同士は、その電気的な偏りのために、引きつけ合います。これによって生じた結合を「水素 結合」と言います。
水素結合は結構強い結合です。大抵の場合、分子間力なんかより、ずっと強いです。ですから水分子同士は結構強くくっついています。
物質が気体になるというのは、分子同士がバラバラに離れる事です。ですから、水が沸騰して気体になるには、この水素結合を切る必要があります。でもこの結合は、今言いました様に、結構丈夫なので、なかなか切れません。ですから水は沸点が100度と、割と高い温度なのです。
(水は分子量18と、結構軽い分子です。このように軽い物質は、沸点は零度以下の低温なのが普通です。それと比較して、100度というのは、かなり高温なんです。)
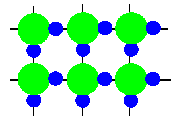
液体の水はこの様に、水素結合で互いに繋がった水分子達が、割と整然と並んでいる状態です。(完全に整然と並ぶと固体の水(氷)ですね)
ではここに物質が溶ける(水和する)というのはどういう事でしょうか?
水に食塩を溶かす場合を考えてみましょう。
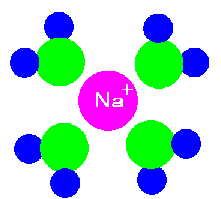
食塩は水に入ると、Na+とCl-に分かれるのでしたね。話を簡単にするため、Na+だけに注目しますね。Na+はプラスに帯電していますので、マイナスを引きつけます。ですから周りの水分子の酸素原子部分が引き寄せられ、周りを酸素原子が内側になるように取り囲みます。この状態でNa+は周りの水と調和 して仲良くやっていけそうですね。
逆にCl-の周りには、水素原子を内側に向けて水分子が集まり、うまく混じり合います。
これが「水和」つまり水に溶けるという事です。
このNa+とCl-の話から分かりますように、水和する(水に溶ける)ためには、電気を帯びている必要があります。電解質(水に入るとイオンに分かれる物質)が水和する仕組みは、今説明しました食塩の原理と同じです。
逆に油が水に溶けない、反発するのは、電荷がないので、Na+等の様に、水分子が周りを取り囲んでくれないためです。
ここで当然生じる疑問は「非電解質だって水に溶ける物があるのはなぜか?」ですね。
例えば砂糖は水に溶けますが、非電解質ですね?
それは、砂糖分子が水分子同様、「分子の中に電気的な偏りがあるから」です。砂糖分子で言えば、分子内に多くの水酸基(-OH)があり、ここが水同様、酸素部分がマイナスに、水素部分がプラスに帯電しています。ここの部分の影響で、水和できる訳です。