 ¿
Es eso una Molécula ?
¿
Es eso una Molécula ? ¿
Es eso una Molécula ?
¿
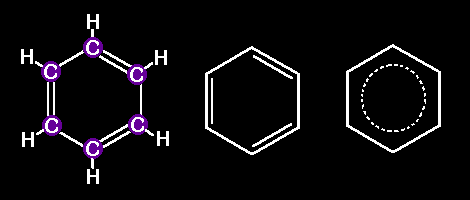
Es eso una Molécula ?La molécula de benceno es la más simple. Seis átomos de Carbono que forman un anillo hexagonal, cada uno de los cuales está enlazado a otros dos átomos de carbono (C) y a un átomo de hidrógeno (H). El químico alemán Friedrich August Kekule fue el primero en descubrir su estructura hexagonal. Los dibujos que siguen son tres formas diferentes de representar una molécula de benceno:
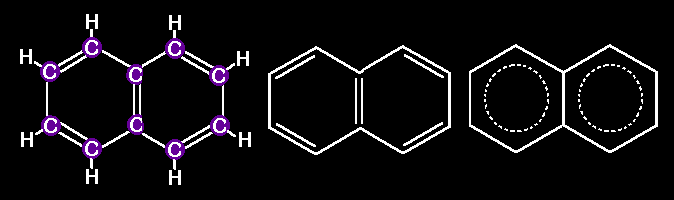
Además
del benceno y el naftaleno hay muchas otras moléculas más
grandes formadas por grupos hexagonales de átomos de carbono. Mira
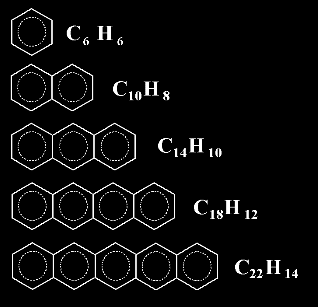
la siguiente serie de anillos fundidos en linea. La tabla incluye el nombre,
la estructura
y la fórmula
de moléculas cada vez más largas ¡ Y todas son representaciones
de MOLÉCULAS QUE EXISTEN DE VERDAD
!
|
Benceno
|
 |
|
Naftaleno
|
|
|
Antraceno
|
|
|
Naftaceno
|
|
|
Pentaceno
|
Probablemente no conoces el nombre
del siguiente miembro de esta serie, una molécula con 6 anillos
fundidos linealmente.
Normal, Yo tampoco se su nombre.
¡ Pero apuesto a que sabrías averiguar su fórmula !.
¿ Quieres intentarlo ?.
¡ Es una serie lógica !
(La respuesta al final de esta
página)
Muy bien. Y ahora, ¿ por qué no juntamos anillos, no a lo largo de una sola dimensión, sino en dos dimensiones ?. Podríamos "inventar" moléculas como las de aquí abajo. Y, de nuevo, resulta que TODAS SON MOLECULAS REALES.
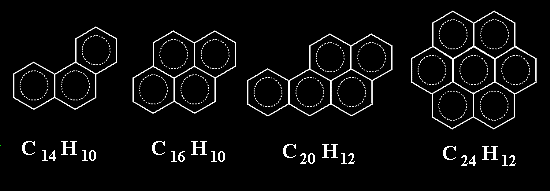
¿ Hasta donde podemos llegar con este asunto de condensar anillos ?.
Pues te puedo contar por ejemplo
que hay un producto natural bastante común (seguramente no muy lejos
de ti en este mismo momento ) que está hecho precisamente de átomos
de carbono ordenados con estructura hexagonal. Es el grafito
y se encuentra en el interior de tu lápiz.
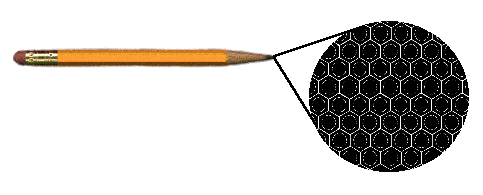
Un grano minúsculo
de grafito esta formado por miles de millones de átomos de carbono
ordenados en capas con estructura hexagonal como se muestra en la figura.
Las capas se apilan unas sobre otras pero sin formar enlaces químicos
entre ellas, y esta estructura es precisamente la que da al grafito sus
propiedades (es blando y exfoliable, se usa como lubricante sólido).
Al pasar del
benceno (líquido) al naftaleno (sólido blanco, funde fácilmente,
soluble en disolventes orgánicos) y al grafito (sólido negro
insoluble, infusible) hemos recorrido un largo camino. El grafito es un
sólido extenso, con propiedades radicalmente diferentes de las de
los sólidos moleculares como el naftaleno o el antraceno.
Por ejemplo,
el grafito es un buen conductor de la electricidad: los electrones se desplazan
a través de ese material "saltando" sin problemas de un átomo
de carbono a otro. Por el contrario, los sólidos moleculares, que
están formados por miles de millones de moléculas individuales
como las que hemos visto antes, son aislantes de la electrcidad. El benceno
o el naftaleno son compuestos donde los enlaces químicos se limitan
a unidades muy pequeñas (las moléculas) que comprenden tan
solo unos pocos átomos ( 10-10
metros, es decir, Angstroms). Por otra parte, en el grafito, el enlace
químico entre átomos se extiende a lo largo y ancho del espacio
en dimensiones relativamente mucho más grandes (10-6
metros, es decir, micras). Hemos saltado de una situación a la otra
muy rápidamente, pero... ¿ que hay de las situaciones intermedias
?.
............ La dimension nanométrica. ..........
¿Hay moléculas
con... digamos... 100 átomos de C? ¿o con 1000?.
¿Cómo
de pequeña podemos llegar a hacer una minúscula partícula
de grafito?.
¿Podríamos
conseguir un fragmento de 100 000 átomos de C?. ¿o de 1000?
¿Podríamos
aislar una sola capa de grafito?
¿Como
podríamos preparar un polímero de anillos fundidos en linea
de formula C40002H20004
?
¿Sería
ese polímero un conductor de la electricidad?
Todas estas son preguntas abiertas, todavía por responder.
El hecho es que
estamos empezando a darnos cuenta de la importancia que tienen las moléculas,
compuestos o sólidos de dimensiones nanométricas. El aislamiento
de semiconductores en dimensiones cuánticas o el descubrimiento
de los fulerenos son sólo un par de ejemplos de nuevos y apasionantes
descubrimientos en este sentido (ver la página Moléculas
calentitas: Fulerenos). Y ¿Cómo es que no se han
sintetizado ya esas moléculas gigantes de carbono?. Bueno, lo cierto
es que los científicos sólo llevan cinco generaciones elaborando
y refinando todos esos compuestos que hoy se ven en los libros de texto
de Química. O sea, que queda todavía mucho por hacer y mucho
que averiguar... en la dimensión nanométrica.
-------------------------------------------------
La formula del sexto miembro de la serie es C26H16
.
En general, la fórmula del enésimo miembro de esta serie
lineal (con n anillos), es C4n+2H2n+4
Última modificación: 9 Feb 1999
©Pedro Gómez-Romero, 1998, 1999
![]() De vuelta a la página principal sobre Ciencia, Tecnología
y Sociedad
De vuelta a la página principal sobre Ciencia, Tecnología
y Sociedad