|
| |
|
|
Segundo
Proyecto Experimental
|
|
|
| |
|
Alcalinidad
|
| |
|
|
| |
|
|
| |
INTRODUCCIÓN
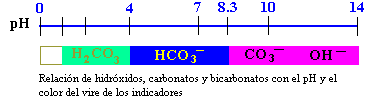
La alcalinidad se define en forma operacional como la capacidad
de una solución (solución / suspensión acuosa diluida de
compuestos orgánicos e inorgánicos, términos usados como sinónimo
de agua) para neutralizar un ácido (CNA), o la cantidad de
ácido que se requiere por litro para disminuir el pH a un valor
aproximado de 4.3, esta capacidad se puede atribuir a la
presencia de bases como; HCO31-, CO32,
y OH1-, lo mismo que a especies presentes en pequeñas
concentraciones de silicatos, boratos, amoniaco, fosfatos y
bases orgánicas.
La acidez es una medida de la capacidad de un agua
para neutralizar una base fuerte, se atribuye a la presencia de
ácidos como H2CO3 y HCO31-
y algunas veces a ácidos fuertes.
Por el carácter ácido o alcalino de las aguas podemos decir que el fenómeno de
neutralización es de suma importancia en
los procesos de tratamiento de las aguas de uso industrial. Es esencial por
ejemplo; la concentración del ion oxidrilo, el cual puede determinar la
concentración de muchos iones metálicos, y
comprender que algunos iones metálicos se comportan como ácidos, como es el caso
del ion férrico, que tiene una fuerza ácida comparable al ácido fosfórico por lo
que gran parte de su química está regida por propiedades ácidas, así mismo; que
el sistema de carbonatos con su influencia sobre el pH de las aguas naturales puede gobernar la solubilidad de
algunos iones
metálicos, propiciando que la composición química de
 éstas se
puedan alterar por la precipitación de minerales y por la subsiguiente
sedimentación de estos sólidos en soluciones sobresaturadas, dañando severamente
los equipos y tuberías. En general podemos decir que; el tratamiento de las aguas, las dosis de productos
químicos requeridos para reducir la dureza (calcio y magnesio) en parte están
controladas por las propiedades ácido-base de la solución que se maneja. éstas se
puedan alterar por la precipitación de minerales y por la subsiguiente
sedimentación de estos sólidos en soluciones sobresaturadas, dañando severamente
los equipos y tuberías. En general podemos decir que; el tratamiento de las aguas, las dosis de productos
químicos requeridos para reducir la dureza (calcio y magnesio) en parte están
controladas por las propiedades ácido-base de la solución que se maneja.
Objetivos:
Familiarizarse con titulaciones ácido fuerte / base débil, a
través de una determinación cuantitativa de la alcalinidad en
una muestra de agua.
|
|
|
| |
Actividades a desarrollar por el alumno:
-
Investigar
acerca de la alcalinidad total de una solución, la
ecuación matemática que la define y las unidades en que
se expresa.
-
Clasificar y
analizar la información para diseñar un experimento.
-
Elaborar el
proyecto, basándose en la utilización del método científico,
para determinar la alcalinidad de una muestra del agua.
Para llevar a cabo la
elaboración del proyecto, basarse en la sección "Cómo elaborar un
Proyecto de Investigación" y en la siguiente guía para realizar la
misma:
-
Alcalinidad
en agua
-
Determinación de calcio y
magnesio
-
Cloruros en una
muestra de agua
-
Investigar
qué reactivos se emplearán en los análisis
mencionados
-
Investigar
cómo y por qué se prepara cada uno de los
reactivos
-
Realizar
los cálculos para la preparación de cada uno de
los reactivos
-
Discutir
y deducir cada una de las ecuaciones que permitan
realizar los cálculos de las concentraciones de
cada reactivo
-
Preparar
y almacenar correctamente cada uno de los
reactivos
-
Investigar
las propiedades físicas químicas y tóxicas de
los reactivos elegidos para la determinación.
-
Investigar
las medidas preventivas, de seguridad y
primeros auxilios en caso de accidentes (al
manipular de manera incorrecta los reactivos, que
se van a emplear en el experimento).
-
Investigar
en que unidades se reporta la alcalinidad y en términos
de qué especies químicas se informa.
-
Explicar
el aspecto teórico de esta determinación con
base en la sexta unidad
-
Investigar
por que se emplean dos indicadores diferentes en
esta determinación
-
Explicar
por qué se debe calentar el sistema antes de
finalizar la determinación.
-
Realizar
cuidadosamente la parte experimental
-
Después de
haber concluido el experimento, realizar una discusión
en grupo (alumnos y profesor) de una manera critica y
guiados por los objetivos intermedios de la unidad
-
Elaborar el Informe
(conforme a los lineamientos de la sección
"Cómo
Elaborar
un
Informe
de
Investigación")
|
|
|
 Bibliografía
sugerida: Bibliografía
sugerida:
|
|
-
Esther Zarco Rubio, Seguridad en
laboratorios, Editorial Trillas, México D.F. 1990. Pág.
64, 65, 78, 85, 86, 97, 98
-
Vernon L. Snoeyink, David Jeankins, John F.
Ferguson, James O. Leckie, Química del Agua, Manual de
Laboratorio, 3ª. Reimpresión, Editorial Limusa, S.A. de
C.V., México, 1995, pp178.
-
Vernon L.
Snoeyink, David Jeankins, Química del Agua, 5ª.
Reimpresión, Editorial Limusa, S.A. de C.V., México,
1999, pp508.
-
Francisco
Buscarons U., Análisis Inorgánico Cualitativo Sistemático,
Editorial Martínez Roca S.A., España, 1971.
-
Gilbert H.
Ayres, Análisis Químico Cuantitativo, Editorial Harla
Harper & Row Latinoamericana, México, 1982.
-
Gessner, G
Hawley, Diccionario de química y de productos químicos,
Editorial Omega S.A., Barcelona España 1993, pp1775.
-
Lang's
Handbook of Chemistry
-
The Merck
Index, Editorial Merck and Co. Inc, USA New Jersey 1996,
20th. Edition
-
American
Society for testing and Materials. Annual book of
Standards 1994
Determinación de Alcalinidad del agua.
Metodo ASTM D 1067-92
-
Standard
methods for the examinatión of water and waste water
publicado por la APHA.
Determinación de Alcalinidad en agua, Método 2320 B -
1995. Método
para análisis de carbonatos y bicarbonatos para agua y
soluciones, Determinación de carbonatos y bicarbonatos
|
|