

感光反応(光を受けて反応する事)をするので、写真のフィルムに利用される。
還元性の検出反応の一つである銀鏡反応に関係する。
感光反応で生じる銀は黒紫色である。
沈殿を生じ易い。
AgF以外のハロゲン化銀、Ag2CrO4、Ag2CO3、Ag2O、Ag2S
また、色がカラフルであるのも特徴。
AgF(黄)(可溶)、AgCl(白)、AgBr(淡黄)、AgI(黄)、Ag2CrO4(赤褐)、Ag2O(褐)
感光反応:2AgCl 2Ag+Cl2
2Ag+Cl2
酸との反応:
塩基との反応:2AgNO3+2NaOH Ag2O+H2O+2NaNO3
Ag2O+H2O+2NaNO3
アンモニア再溶解反応:Ag2O+H2O+4NH3 2[Ag(NH2)2]++2OH-
2[Ag(NH2)2]++2OH-
ハロゲン化銀はAgFを除いて沈殿する。
色はいろいろあり、AgClは白、AgBrは淡黄色、AgIは黄色である。
(AgCrO4は赤褐色)
ハロゲン化銀には感光性がある。つまり光を当てると、Agが遊離するそのため色が黒くなる。
これが写真のフィルムの原理である。
食器によく使われる。
例えば銀メッキのスプーンを作る場合、銅合金などでスプーンを作り、ジシアン銀(|)酸カリウムK[Ag(CN)2]水溶液を電解液にして、そのスプーンを陰極、純粋な銀を陽極にして電気分解する。すると銀メッキのスプーンになる。
臭化銀は、水にはほとんど溶けないが、チオ硫酸イオンを含む水溶液には良く溶ける。この理由を考えてみよう。
水溶液中の臭化銀の溶解度積は、室温で4.9・10-13(mol/l)2である。したがって、臭化銀の飽和水溶液のモル濃度は7.0・10-7(mol/l)になる。またチオ硫酸ナトリウム水溶液に臭化銀を加えると、次の(A)式で示したように、銀イオンは錯イオンをを作って溶け易くなる。ここでS2O32-は配位子として銀イオンと結合している。
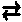 [Ag(S2O3)2]3- + Br- ・・・・・・(A)
[Ag(S2O3)2]3- + Br- ・・・・・・(A)
(中略)
写真のネガ(陰画)を得る過程を化学的に説明する事ができる。写真用フィルムは、臭化銀の結晶をゼラチン溶液中に分散させて高分子膜上に塗布したものである。これに光が当たると、結晶の内部で(C)式に従って、銀が遊離し、目に見えない潜像がフィルム上にできる。
これを現像液に浸すと、液中に含まれているヒドロキノン等の還元剤に作用にによって、潜像のまわりから黒くなって行く。つぎに、未反応の臭化銀を、チオ硫酸ナトリウムを含んだ定着液に浸して錯イオンをとして溶かし去ると、ネガが得られる事になる。この時実際にフィルム上で画像形成に使用されている銀はごくわずかで、大部分は洗い流されて廃液中に移る。
(以下略)
[滋賀医科大学(出題時赤字空欄)]