「イオンになり易い度」の順番。左に行けばいくほど、イオンになり易い。
原則として、イオン化傾向がHより大きい金属は、酸に溶けて水素を発生します。
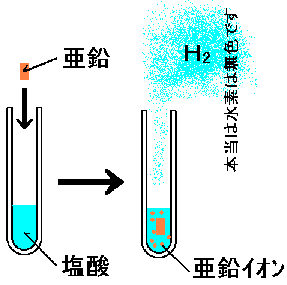
例えば亜鉛を塩酸に入れると、溶けて水素が発生します。
なぜでしょうか?

それはこういう事です。
塩酸の中には、大量の水素イオンH+が存在します。一方金属亜鉛はZnでイオンではありません。
ところで亜鉛の方がイオン化傾向が水素より大きい、つまり「亜鉛の方が水素よりも、イオンになりたい気持ちが強い」訳です。
ならば、塩酸の中に亜鉛がイオン化せずに存在するのは不自然ではありませんか?
そこで、亜鉛はイオンになります。
が、これでは電子が余ってしまうので、誰かが受け取れなくては成りません。
そこで相対的にイオンに成りたい度合いが小さい水素が、電子を受け取る訳ですね。
この事が分かれば、イオン化傾向が水素より小さい元素、例えばCuやAgは酸に溶けない事が分かりますね。
(ただし例外として、硫酸や硝酸には、溶ける事は溶けます。しかし、水素は発生しませんでしたね。酸化還元反応を参照の事)