
さて、sp3混成軌道によって、メタンの共有結合は説明出来ましたが、それではエチレンCH2=CH2の結合は説明出来ません。
エチレンの様に二重結合を持つ分子では、sp3ではなく、sp2混成軌道でできている場合が多くあります。
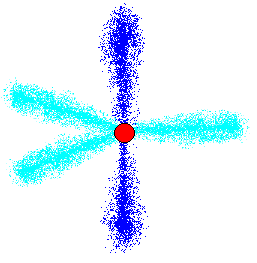
sp2混成軌道というのは、その名前の通り、s軌道とp軌道二個が溶け合ってできた新しい電子雲です。
でも、もともとp軌道は3個あった訳で、sp2を作るには二個しか使っていませんから、p軌道は一個、そのまま残っています。
絵では水色に描いてあるのがsp2混成軌道、青色なのが残っているp軌道です。
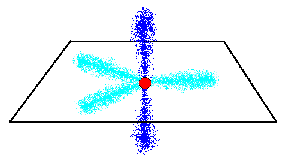
出来上がった3個のsp2混成軌道は、同一平面内にあって、互いに120度の角度を成しています。
残っているp軌道は、その平面に直交するように存在しています。
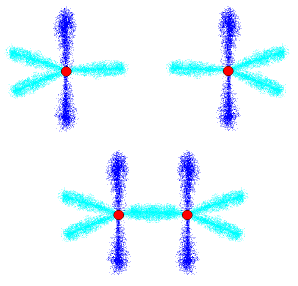
こう考えると、エチレン分子の構造が説明出来ます。
まず、二個の炭素原子がsp2混成軌道を採り、接近します。結果として、sp2混成軌道の内の一本を使って結合が起こります。
これは一本でしか繋がっていませんから、単結合であり、二重結合ではありません。
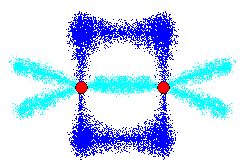
ところでこの状態では、残っているp軌道がすぐとなりに存在する事になりますね。ですから、この二個のp軌道は混じり合って繋がる事が出来ます。
こうして二本目の結合ができます。(上下に二本あると思うかもしれませんが、上下とも同じ一本のp軌道なので、一本と数えます)
これが二重結合なんですね。
この事から分かりますように、二重結合というのは、同等の結合ではなく、二種類の違った結合で出来ているのですね。
最初のsp2でできた結合は、通常の単結合と同等の強度を持った結合で、σ(シグマ)結合と言います。単結合同様ですから、かなり強い結合です。
一方、残ったp軌道が溶け合ってできた結合は、かなり弱い結合です。比較的に容易に切れます。こっちの結合はπ(パイ)結合と言います。

で、エチレンの場合は、残っているsp2軌道に水素原子が結合して完成します。
こういう仕組ですから、エチレンを構成する6つの原子は全て常に、同一平面内にあります。
二重結合を持っている分子の多くは、この軌道を採っています。
そのため、単結合とは違う問題が生じます。
次のページでは、その事を説明しましょう。