 CH3COO- + H+
CH3COO- + H+
(平衡状態を御読みでない方は、そちらから御読み下さい。)
 CH3COO- + H+
CH3COO- + H+例えば酢酸(お酢の事です)を例に考えてみましょう。酢酸CH3COOH はなめてすっぱい事から分かります様に、酸の仲間です。早い話が、H+を放出できるんですね。
唯、 平衡状態を読んで頂けば分かりますように、全ての酢酸が電離する訳ではないんですよ。
上の電離式を正しく書くと、
 CH3COO- + H+
CH3COO- + H+なんですね。実際には、加えた酢酸の一割も電離しません。(状況に依るので、一概には言えませんが)
この様に、あまり電離しない酸を「弱酸」と言うのでした。
で、状況次第で、どの位電離するかが変わると言う事に関して、もう少し詳しく説明しましょう。
(以下に用いる数字は、話を分かり易くするために、かなり極端な数字を使っています。現実にはこんなに極端にはなりませんよ。)

ビーカーに水を入れて、酢酸分子CH3COOHを、100粒入れたとします。
当然電離をしますが、平衡状態になるので、
 CH3COO- + H+
CH3COO- + H+
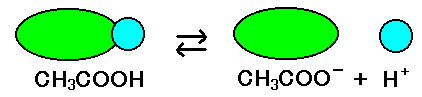
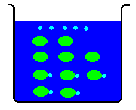
CH3COOHのままの奴も居ます。
話を簡単にするために、半分だけ電離したとします。(本当は、そんなには電離しません)
つまり、
CH3COOH = 50粒
CH3COO- = 50粒
H+ = 50粒
という事ですね。
ここに塩酸を加えてみましょう。
塩酸も酸なので、H+の数が増えますね。
塩酸によるH+が50粒加わったとしますね。
すると、
CH3COOH = 50粒
CH3COO- = 50粒
H+ = 50粒 + 50粒 = 100粒
で、H+はトータルで100粒になりそうですね。
でも実際にはそうはならないんです。
どうして?
それはこういう事なんです。
確かにH+を50粒加えた訳ですから、本当にごく一瞬の間、H+ は100粒に増えるのは増えるんですよ。
でもすぐに、
 CH3COO- + H+
CH3COO- + H+この左向きの反応が強くなって、CH3COOHに戻る分子が増えるのですよ。
例えば一端(一瞬の間だけ)100粒にH+のうち、CH3COOHに10粒戻ったとすると、
CH3COOH = 50粒 + 10粒 = 60粒
CH3COO- = 50粒 − 10粒 = 40粒
H+ = 100粒 − 10粒 = 90粒
H+は90粒、つまり増加したのは50粒ではなく、40粒になります。
つまり本来「50粒の変化」が起きるべきところが、「40粒の変化」に押さえられるのです。
なぜか?
そう、CH3COOH  CH3COO- + H+の反応が存在するからなんですね。
CH3COO- + H+の反応が存在するからなんですね。
え? それじゃあ説明になってないって?
ま、そうですね。(^^;)
では、もう少しちゃんと話をしましょう。
「H+を50粒加えたら、平衡反応のせいで、増加量が40粒に押さえられた」んでしょ?
それは「自然は変化を嫌う」からです。
(詳細は理科のお話参照)
これ、中学校でも出てきたの、覚えてますか?
電磁石の話です。
電磁石に永久磁石を近づけると、「永久磁石の影響を打ち消すように」電流が流れるんでしょ?
別に、之に限った話じゃないんですよ。一般に自然は変化を嫌うんです。
例えばお金だってそうですよ。
君は、大金が入ったら、お金をいっぱい使いませんか?
増えた「お金の変化」を打ち消すように行動しているんでしょ?
逆にお金が無いときは、できるだけ使わないようにしますね。
足りないお金を増やす方向に行動している訳です。
これは「人間の意志」が入ったせいだと言われると困るので、人間の意志と関係無く、自動的に起こる例を挙げましょうか?
例えば人間の体重変化なんかがそうですね。
体重が増えれば、身体の消費エネルギー(基礎代謝量と言います)が増え、自動的に体重を減らす方向に、身体が変化します。逆に体重が減ると、基礎代謝量が減り、体重の減少を自動的に食い止めるような状況が生じます。
これは意識しなくても起きます。
そうです。自然は変化が嫌いなんです。