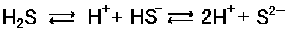
硫化物は複雑です。
例えばCu2+が含まれる水溶液にH2Sガスを吹き込めば、硫化銅CuSが沈殿します。
一方でNa+が含まれている水溶液に吹き込んでも、何の反応も起きません。
ところがややこしいのが、Zn、Fe、Niの三つです。こいつらは塩基性に限って硫化物が沈殿しますが、酸性では沈殿しません。
なぜこんな事が起きるのでしょう?順に説明しましょう。
まずCuSが沈殿する理由を考えてみます。
イオン化傾向を考えて見てください。Cuはイオン化傾向が小さいですね。つまりもともとCuは、イオンで居るのは好きではないのです。(不安定な訳ですね) ですから、比較的簡単に硫黄Sと合体して沈殿します。
一方でNaはイオン化傾向が非常に大きいですね。ですから基本的にイオンのままで居るのが好きで、あまり他の物質と化合したくありません。ですからSがあっても知らん振りで、化合しません。ですから沈殿しません。
で、問題無のがイオン化傾向がちょうど中くらいの連中です。ここでは、Zn、Fe、Niの三つです。
彼らはまあまあ化合したいけど、まあまあイオンで居るのが好きなのです。ですから「硫黄Sがいっぱいあるのなら、化合してみようかなぁ」という感じのノリなんですね。
ここまでOK?
で、ここでH2Sについて、詳しく考えてみましょう。
水に吹き込まれたH2Sは電離して、H+とS2-に分かれます。
こうして生じたS2-が、Cu2+などの金属イオンと合体する訳ですが、ここに一つ、重要な問題があります。
「H2Sの電離は完全には進行しない」という事です。
ここで「平衡状態」が分かっている必要がありますので、分からない人はまず、ココを読んで下さい。
で、H2Sに話を戻しますと、このように電離します。
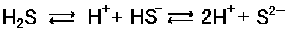
H+が出ますから酸です。しかも二つ電離しますね。
絵で描くと、

ですね。黄色の丸が硫黄イオンで、水色が水素イオンです。
で、大事なのが「全部が電離する訳ではない」事です。
例えば(あくまでも”例え”ですよ)、ビーカーに100粒のH2Sを溶かしたとしましょうよ。で、100粒全てが2H++S2+に別れる訳ではないんです。
50粒だけがH++HS-に電離したとしますね。で、さらにその内の10粒が最終段階の2H++S2+まで分かれたとします。
となれば、全体の50粒は、電離せずにH2Sのままで残っているし、40粒はHS-で止まります。S2-になるのは10粒だけなんですね。つまりこの状態で平衡が保たれている訳です。
ここでルシャトリエを考えて見ましょう。

このビーカーに塩酸を加えるなりして、酸性にしてみて下さい。リュシャトリエから、変化を打ち消す方向へ平衡が移動するのだから、増えたH+が減る様に、H2Sの平衡が左にずれるはずですね。そうすれば、H2Sから来たH+が減るから、ビーカーのH+増加は、唯HClを加えるよりも小さくなります。
唯、副作用があります。平衡が左にずれたので、S2-の数が減りますね。 本来HClとS2-は関係無いはずなんですが、H+の調整のために巻き込まれてしまうのですね。
すると最初に書きましたように、Zn、Fe、Niは、まあまあS2-化合したいだけなので、「硫黄Sがいっぱいあるのなら、化合してみようかなぁ」という感じのノリなんです。ですからS2-が減ったこの状態では、Zn、Fe、Niは沈殿を生じないのです。
では逆に、塩基性にした場合、例えばNaOHなんかを加えた場合の話を考えてみましょう。
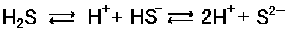
NaOHがH2Sから生じたH+を食べてしまいます。つまりH+は減っちゃうんですね。ですからそれを、補わなくてはなりません。
ですから平衡は右に動きます。ですから副作用として、S2-が増えます。
この状態でなら、Zn、Fe、Niも、硫化物として沈殿するんですね。