
銅イオンCu2+が水に溶けている場合を考えましょう。
実は銅イオンが水中にある場合、イオンは単独で漂っている訳ではないのです。
銅は遷移元素ですから、M殻とN殻に、あちこち電子の空きがあります。ですから非共有電子を持っている分子が配位結合してくる事が可能です。
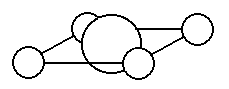
ですから銅はもともと、左の図にあるように、水平方向に4個所、配位結合を受け入れる場所をもっています。水中ではその4個所の受け口に水を入れて浮いています。

右の絵では水色の丸の所に水分子が入っていて、水分子の非共有電子対を使って、配位結合をしています。
ですから全体としては、[Cu(H2O)4]2+という分子として行動しています。(周りの水分子は電荷を持たないので全体が2+なのは変わりません)
で化学では「水は省略してよい」というルールがありまして、ですから普段は(H2O)4の部分は略して書きません。だから普段はCu2+と書きます。
この事が分かると、化学反応の見方もかなり変わりますよ。
 Cu(OH)2 + 2Na+
Cu(OH)2 + 2Na+例えば、銅と水酸化ナトリウムの反応を考えてみましょう。
今までは上のような反応として覚えてきたと思いますが、配位結合した水まで考えると、下のように見えます。
 [Cu(H2O)2(OH)2] + 2Na+ + H2O
[Cu(H2O)2(OH)2] + 2Na+ + H2O
どうでしょう? この反応から水を省略したのが、最初の反応式ですね。
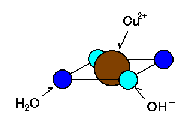
ところで[Cu(H2O)2(OH)2]の部分をよく見てみましょう。
絵に描いてみますと左のような感じです。
OH-が二つありますのでマイナスが2つで、Cu2+はプラスが2ですから、トータルで電荷零ですね。
電荷がないと水和(水に溶ける事)ができないでしょ?
ですから Cu(OH)2 つまり[Cu(H2O)2(OH)2] は水に溶けられないので沈殿する訳ですね。
この事が分かると、両性元素やアンモニア再溶解元素の反応の仕組が良く分かるようになります。
その辺を知りたい人は、次へ進んで下さい。