さて、先に述べましたように、金属イオンは水分子と配位結合をして存在しているのですが、両性元素の再溶解にも、このことは非常に関わっています。

銅Cuは両性元素ではないので、例としてアルミニウムを使いましょう。
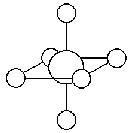
アルミニウムは銅と違い「配位数6」、つまり六ヶ所の配位結合する場所を持っています。立体的な位置は、左の図の通りです。
水に溶けたアルミニウムイオンAl3+は、正確には[Al(H2O)6]3+の形で存在している訳です。
ここで「少量の」水酸化ナトリウムNaOHを加えた反応を考えてみましょう。
 Al(OH)3 + 3Na+
Al(OH)3 + 3Na+
ですね、これで水酸化アルミニウムの沈殿 Al(OH)3 が生じるのですが、配位水まで考えると、こう書けます。
 [Al(H2O)3(OH)3]+ 3Na+ + 3H2O
[Al(H2O)3(OH)3]+ 3Na+ + 3H2O
ね、6個あった配位水 H2O のうちの3つが、中和反応
 OH- + H2O
OH- + H2O
でH+を失います。(上の青い部分が配位水で、緑の部分はNaOH)

図で書くとこんな感じです。
これが3回起きると、アンモニアイオンはトータルの電荷が零になりますでしょ? (Al3+とOH-が三つだから) ですから水に溶けられなくなって、沈殿します。
ところが、ここにさらに NaOH が加わった場合を考えて見てください。
[Al(H2O)3(OH)3] にはまだ3つの水分子が残っていますから、もう一回反応が起きまして、
 [Al(H2O)2(OH)4]-+ Na+
+ H2O
[Al(H2O)2(OH)4]-+ Na+
+ H2O
そうすると、[Al(H2O)2(OH)4]-は、トータルでマイナス1の電荷を持ちますから、水に溶けれれます。ですから再溶解が起きる訳です。
これが両性元素再溶解の原理です。