酢酸(CH3COOH)は「お酢」の主成分です。場合によりますが、大体3%程度の濃度の様です。
で、その濃度を決定する問題がよく出題されますが、その問題はかなり複雑な問題です。
というのは、酢酸は酸性ですから、塩基例えば水酸化ナトリウムなんかで中和してやれば、濃度が決定出来るはずです。これ自体は間違っていません。
しかしなぜか出題される問題は、その前に必ずシュウ酸二水和物((COOH)2・2H2O)と水酸化ナトリウムとの中和が出題されます。
つまり、まずシュウ酸と水酸化ナトリウムの中和をしてから、その水酸化ナトリウムと酢酸の中和をするという話の流れになっています。
なぜ、そんなややこしい事をするのでしょうか?
ただ問題を煩雑にするために、そんな手の込んだ問題になっているのではないのです。ここではその理由を考えてみましょう。
まず、酢酸を滴定するために、水酸化ナトリウム水溶液を作ります。水酸化ナトリウムの分子量は 40 ですから、40.0mgを 天秤で測って100mlの水に溶かせば、0.01 mol/l の水酸化ナトリウムが出来そうな気もしますが、そうはならないんですよ!
だって、水酸化ナトリウムは潮解するでしょう?だから、NaOHの固体のつもりでも、吸収した水分の質量も混じってしまいます。また、空気中の二酸化炭素とも反応してしまうので、炭酸ナトリウムになってしまいます。
ですから、重さ(正しくは「質量」ですけど)を測ろうと思って天秤に載せたら、その間にNaOHが化学反応で、違う物質に変わってしまいます。こうなると、何の質量を測っているか分からないですね?つまり 40mg を測っても、いったい何gが本当にNaOHなのか分からないでしょう?
だから特定の濃度の水酸化ナトリウム水溶液を作る事はできないんです。
そこで、分からないから、「適当な濃度」の水酸化ナトリウム水溶液を作っておいて、その濃度は後から求める必要があるのです。
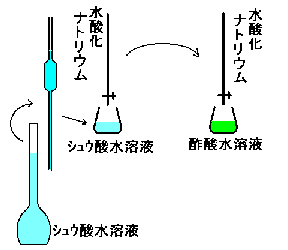
そこで登場するのが、シュウ酸二水和物((COOH)2・2H2O)です。
シュウ酸二水和物は水酸化ナトリウムと違って、非常に安定な物質です。ですから天秤で量り取れば、かなり正確な量が量り取れます。
ですからそれを水に溶かし、メスフラスコで濃度を調整すれば良いんですね。これを使って水酸化ナトリウムを中和すれば、水酸化ナトリウムの濃度が決まるでしょう?
この水酸化ナトリウムで酢酸を滴定すれば、酢酸の濃度が決まる訳です。
「じゃあ、初めからシュウ酸で酢酸を滴定すればいいじゃないの?」と思うかもしれませんが、それはダメですよ。だって、どっちも「酸」だから、中和にならないでしょ?(^^)