炭酸ナトリウムNa2CO3は工業・化学的に重要な物質なので、化学的に合成する必要があります。
もちろん、
で合成する事は可能です。しかしこれは、(工業的には採算が合わないので)実用的ではありません。なぜならNaOHを合成するためには、海水の電気分解である隔膜法をする必要があり、これに莫大な費用が掛かるからです。
そこで考えられた方法が、アンモニアソーダ法(ソルベー法)です。これは原料が「海水(NaCl)」と「石灰石(CaCO3)」と安価で、電気分解などの費用が掛かる操作が要りません。ですから実際にはこの方法が利用されています。
この方法は、化学の性質を上手に利用しています。そのため、化学が理解出来ているかを調べる「大学入試」では出題されやすい訳です。
基本的には、二段階の反応から成ります。
アンモニアソーダ法の最大のポイントは、この初段反応です。基本原理は「NaHCO3がNaClほどには水に溶けない」 事ですが、これは後で説明します。
二段回目は、目的のNa2CO3を得るための反応で、アルカリ金属の炭酸塩の熱分解を利用しています。
工業的な製法ですから、効率よく反応する必要があります。
そこで、主反応をサポートする反応が必要になります。
一つ目は、原料から「主反応で使う二酸化炭素」と「アンモニアの再生反応で用いる水酸化カルシウムを得るための炭酸カルシウムを得る」ための反応です。アルカリ土類金属の炭酸塩の熱分解を利用しています。主反応二段目との違いに注目しましょう。
二つ目は、その、アンモニアの再生反応で用いる水酸化カルシウムを得るための反応です。
三つ目は、その「アンモニアを再生させる」反応です。
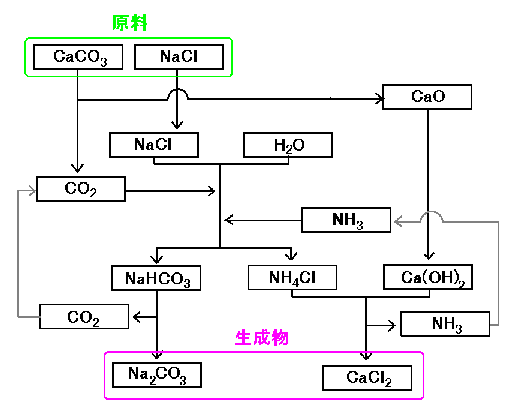
これらは、反応の全体像を見るとよく分かります。

全体像は上の通りです。原料として石灰石(CaCO2)と海水(NaCl)を加え、途中過程でいろいろな物質が絡みますが、結局は、原料の塩の組み替えが起きて、Na2CO3(主産物)とCaCl2(副産物)を得ます。
その他の物質は、ただ循環している事に注目して下さい。
主反応、
の仕組が重要です。
この反応は、ある意味で不思議な反応です。
というのは、
というのは有名な沈殿反応ですね。これの逆反応な訳でしょ?じゃあ、普通には反応が起きないはずじゃないですか。
そこで利用されるのが、「NaHCO3がNaClほどには水に溶けない」という性質です。
どういうことでしょうか?
それはこういう事です。
まず最初に、食塩水を飽和させておきます。つまりNa+は、既にめい一杯存在するようにしておくわけです。
ここに二酸化炭素とアンモニアを入れます。
二酸化炭素は弱酸で、アンモニアが弱塩基ですから、中和反応が起きますね?
で、HCO3-が生じます。これと、既にめいいっぱい存在したNa+が結合して、NaHCO3が生じます。
もちろんNaHCO3は水に可溶ですが、余り多いと飽和します。ですから、あまりたくさん二酸化炭素を吹き込めば、NaHCO3が沈殿するはずです。(「NaClほどには溶けない」事を利用している訳ね)
沈殿したらこっちのもので、これを濾過なりなんなりして取り出せばよいですね。これが、主反応の第一段階です。