 CH3COO- + H+
CH3COO- + H+
では今度は、弱酸のPHを求めてみましょう。
まず、0.1mol/lの酢酸があるとしましょう。
塩酸の時と同じ濃度ですから、PH=1になりそうなものですが、違うんですね。
ここで平衡(できればルシャトリエを読んで下さい)の話を思い出して見てください。
確かに酢酸は電離をしますが、平衡状態になるので、
 CH3COO- + H+
CH3COO- + H+
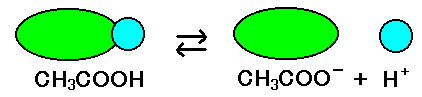
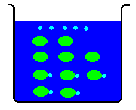
電離しないで CH3COOH のままの奴も居ます。
ですから「酢酸0.1mol/l」と言われても、[H+] = 0.1mol/l という事にはならないのです。
ですから「存在する酢酸分子が、どの程度(何%)電離するか」が分かっていなければ、[H+]は分かりません。この電離する割合(確率)を「電離度」と呼びます。
今回は酢酸が10%電離しているとしましょう。これを「電離度 = 0.1」と呼びます。
ですから、
[H+] = 0.1・0.1
= 0.01
になります。ですからPH=2になります。
弱酸では、この「電離度」を考える事を忘れてはいけません。
補足:
では、強酸では「電離度」を考える必要はないのでしょうか?
正確には考えなくてはなりませんが、強酸ではほぼ「電離度 = 1.0」、つまり 100% 電離していると考えて良いのです。(実際にはほぼ100%であり、100%ではありません。少しは電離しない奴も居ます。)
ですから、実際には考える必要はありません。