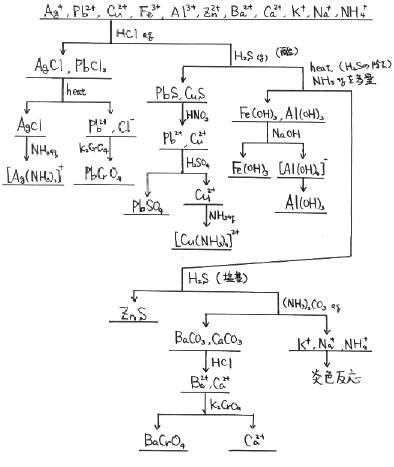

実際には河の水の中に、どんな元素が溶けているか、工場廃水に何が含まれているかを調べたりするのに実際に用いられる分析方法の基本がコレです。(ま、現在は、もっと簡単な方法があるのですがね)
例えば調べたい水に塩酸を加えてみます。
そうした時、白い沈殿が生じたとしましょう。その場合、恐らくその水には、AgかPbが含まれていたと推測出来ますね。(AgClとPbCl2は白い沈殿だから)
で、沈殿が生じなかったら、恐らくAgもPbも含まれていなかったのでしょう。
この要領で、水に何が溶けているかを調べてみましょう。
手順にはノウハウがあり、基本的には以下の手順を、以下の順番に行います。
最初は丸暗記するつもりで、やって下さい。
なお、沈殿のページを見ながら読むと、分かり易いですよ。
まず問題の水溶液に、塩酸を加えてみます。
水銀には何かと問題があるので、最近は出題数が減っています。まず最初は、問題文に「塩酸を加えたら白い沈殿ができる」と書いて合ったら、銀か鉛を疑って下さい。
また生じた沈殿を温めてみて、溶けたらPbCl2で、溶けなかったらAgClです。PbCl2は熱に対して不安定ですが、AgClは安定ですから。これでどちらが溶けていたか区別出来ます。
塩酸を加えた後で、硫化水素を加えますから、酸性状態での硫化物沈殿の応用です。
硫化物の沈殿とPHを読んでもらえば分かりますが、硫化水素を加えて沈殿する元素は、PHによって異なります。
酸性で沈殿するのは、イオン化傾向がスズより小さい元素ですから、沈殿が生じたら、銅か鉛が疑わしいです。(鉛は塩酸を加えた時点で沈殿して除かれていますが、PbCl2が不安定なので、まだ水溶液中にPbが残っている可能性があるため、ここでPbSが沈殿する可能性があります)
沈殿が生じた場合、銅か鉛を区別する場合、一端硝酸を加えて沈殿を溶かし、(硝酸塩は、どの元素も原則として水溶性ですから)その後硫酸を加えます。それで沈殿したらPbでしょう。
沈殿しなければ、恐らくCuですが、念のためアンモニア水を加え、濃青色になる事を確認すれば、Cuである確信が持てるでしょう。
次に加熱して、溶かした硫化水素を気体にして取り除きまして、アンモニアを加え塩基性にします。
塩基性水溶液になりますから、鉄やアルミが溶けていた場合、水酸化物として沈殿するはずです。
なお、アンモニア水を使い、水酸化ナトリウムを使わない理由は、アルミが両性元素だから、沈殿しないからです。
また、問題文によっては、より正確に「加熱してから、硝酸とアンモニアを加える」と書いてある場合があります。正しくは硝酸を加えた方が望ましいです。
といいますのは、さっき硫化水素を加えましたでしょ?
硫化水素は還元剤でもありますから、水溶液に溶けていたFe3+の一部が還元されて、
になっている可能性があります。ですからFe3+とFe2+が混在している可能性があります。
そこでFe2+を元のFe3+に戻すために、酸化したいので、硝酸を加えるのです。(硝酸は酸化剤です)
次にもう一度、硫化水素を加えます。
先程アンモニアを加えましたから、今は塩基性になっています。
塩基性での硫化物の沈殿ですから、さっきは沈殿しなかった亜鉛が沈殿出来ます。
炭酸アンモニウムを加えると、アルカリ土類の炭酸塩が沈殿します。
ここまで来ると、大抵の元素は沈殿で取り除いているので、残っているのは恐らくアルカリ金属です。これは沈殿しませんから、炎色反応で確認する事になります。